- 团队介绍:
CRISPR介绍---CRISPR应用及分类
在对CRISPR系统的基本功能以及发展史进行了简单的介绍后(详情可参见CRISPR介绍---CIRSPR发展史),本篇文章将主要介绍CRISPR/Cas系统的应用、免疫机制及其分类。
由于CRISPR/Cas系统的靶点特异性结合和切割能力,以及仅通过改变gRNA的序列就可以定位到任何基因位点,因此在基因编辑和诊断领域都展现出了极大的应用价值 。
目前,在基因编辑领域,CRISPR/Cas9应用最为广泛。该系统由crRNA与tracrRNA通过碱基配对结合在一起,形成嵌合RNA(tracrRNA/crRNA),然后借助crRNA与靶DNA位点进行碱基配对,通过这种方式,嵌合RNA就能够引导Cas9结合到靶位点上并进行切割,防止外来遗传物质入侵。
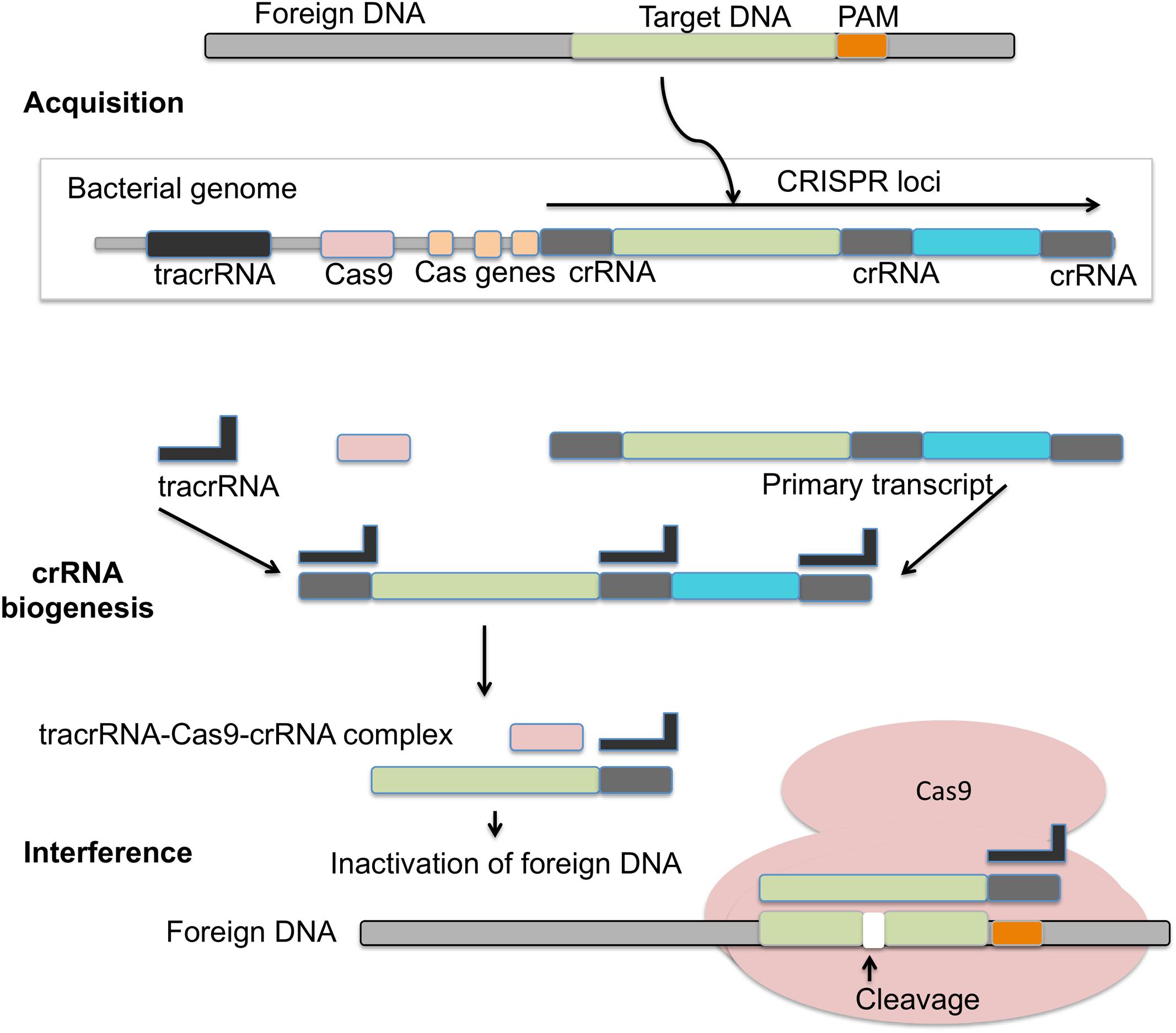
CRISPR/Cas9作用机制
CRISPR/Cas9系统构成简单、特异性优良、切割效率高,广泛用于编辑各种生物体内的基因。以CRISPR/Cas9为代表的基因编辑技术已经在一系列基因治疗领域展现出了巨大的应用前景,如血液病、遗传疾病、肿瘤等。与Cas9 相比,Cas12a(Cpf1)只需一个协助RNA分子,酶分子量比Cas9小,进入细胞更容易,选择灵活性更大,且会产生黏性末端,便于新DNA序列插入,因此给基因编辑提供了更多的可能性。
在产业化开发领域,越来越多的公司专注开发基于CRISPR/Cas系统的基因编辑治疗药物,如Editas Medicine和CRISPR Therapeutics,前者由华人科学家张锋领导,后者的联合创始人是Emmanuelle Charpentier。值得一提的是,CRISPR Therapeutics与合作伙伴Vertex制药公司在2019年04月宣布,美国食品和药物管理局(FDA)授予公司基因编辑疗法CTX001用于治疗输血依赖性β地中海贫血(TDT)的快速通道资格。除此之外,还有很多不同治疗方向的药物处在研究阶段(部分如下表所示)。通过对已有基因编辑工具的优化以及新工具的发现,不断提高精准度和效率,期望可以为临床疾病的治疗提供新的模式。

基于CRISPR/Cas系统基因治疗的临床试验
(来源于https://clinicaltrials.gov/ct2/home; https://crisprmedicinenews.com)
在诊断方面,CRISPR/Cas系统中存在一些特殊的功能蛋白,如Cas12、Cas13等,这些酶在gRNA的引导下,能够在识别目标序列后启动靶向切割活性,同时还能非特异性切割体系内的DNA或RNA分子(也称为“反式切割”)。如果在反应体系中加入带有荧光基团的报告核酸分子,利用反式切割活性,使报告分子释放出荧光信号,即可提示目标核酸分子的存在,这些构成了CRISPR/Cas 系统诊断技术的基础。
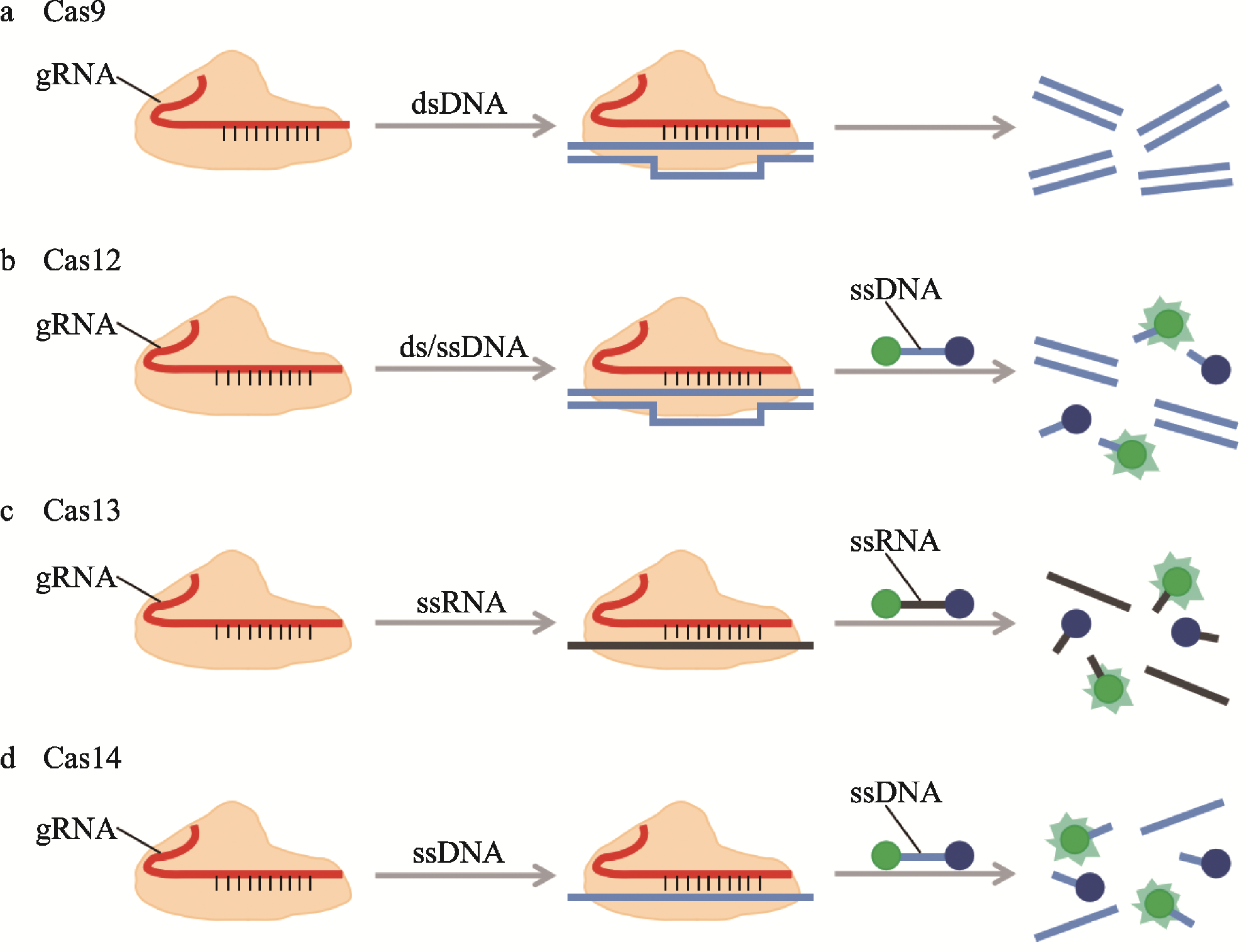
不同CRISPR/Cas 系统的切割活性
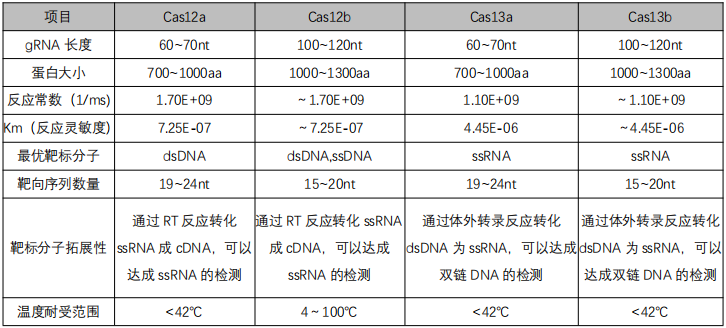
Cas12与Cas13参数比较
目前,CRISPR/Cas系统在不同的诊断领域也都有较多的进展,如病原检测、SNP检测等。部分信息如下:
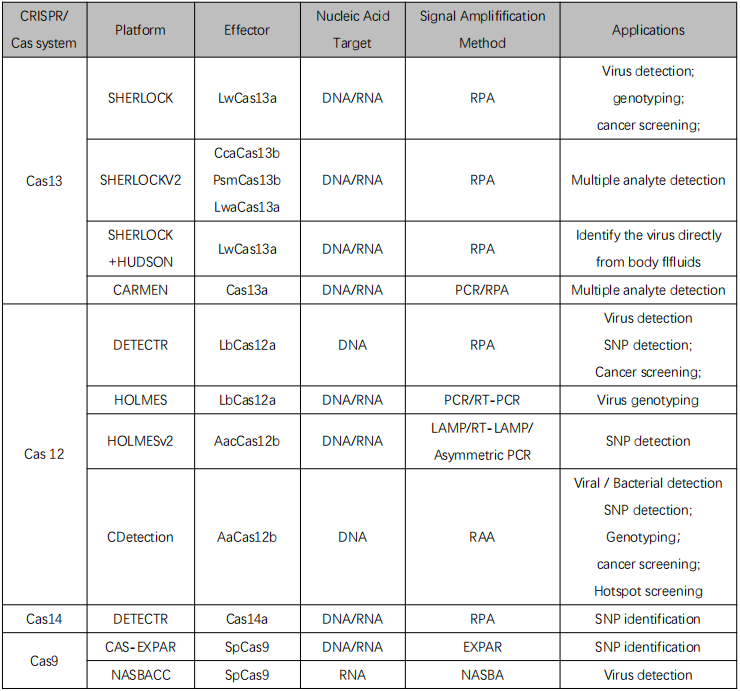
基于CRISPR/Cas系统的核酸诊断方法
CRISPR/Cas系统之所以能够在基因编辑及诊断领域广泛应用,主要基于不同功能的Cas蛋白能够在特定位点触发核酸的断裂,这与CRISPR/Cas系统的免疫防御机制是一致的。CRISPR/Cas系统进行免疫防御主要分为3个阶段:适应(Adaptation )、表达(Expression)和干扰(Interference)。首次入侵的外源DNA的前间隔序列被古菌或细菌中的Cas蛋白获取,并作为间隔序列插入CRISPR中的两段重复序列之间,即为适应阶段。当外源DNA再次入侵时,细菌开始转录CRISPR,形成初级转录产物pre-crRNA,再由核糖核酸酶或Cas蛋白在重复序列位点内切割形成成熟的crRNA,则为表达阶段。最后的干扰阶段,成熟的crRNA与特异的CRISPR效应蛋白形成核糖核蛋白复合体,识别并切割能与crRNA互补配对的外源DNA,从而降解病毒的核酸,达到免疫防御的目的。利用这种原理再加上被切断的双链DNA能够激活细胞的非同源末端连接 (NHEJ) 或同源重组 (HR) 两种修复机制,从而实现基因的敲除、插入或修饰,也就实现了基因编辑的目的。
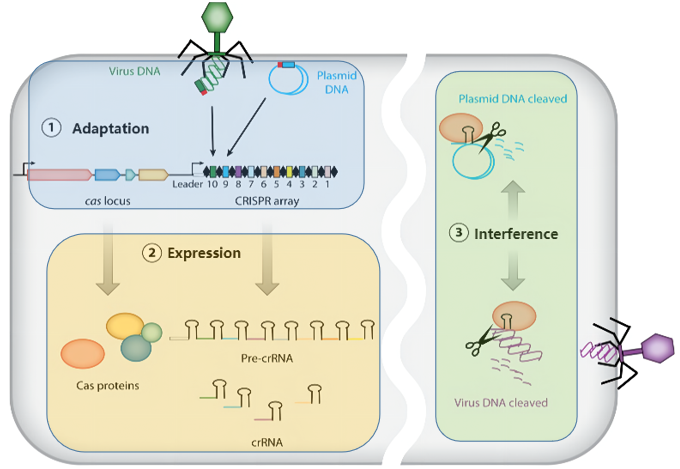
CRISPR/Cas系统免疫防御机制
在免疫防御过程中,不同类型的Cas蛋白在CRISPR系统适应、表达、干扰等作用阶段发挥的功能各异。根据Cas蛋白的组成不同和效应复合物的性质,CRISPR/Cas系统分为2大类,即Class1和Class2。其中,Class1系统的效应复合物由4-7个Cas蛋白亚基组成,该类别的共同特征是利用多个Cas蛋白效应复合物实现干扰靶标核酸;而Class2系统的效应复合物则是单个多结构域蛋白,如Cas9、Cas12等。另外,根据剪切模块的序列和功能特征,以及辅助模块的构成,Class1又分为3种类型即TypeⅠ、Ⅲ、Ⅳ,Class2分为TypeⅡ、Ⅴ、Ⅵ,详细信息如下图所示。

CRISPR-Cas 系统架构及功能模块
从上图可以看出,(1)在适应过程中,CRISPR/Cas系统获得新的免疫记忆主要通过Cas1和Cas2蛋白的参与;(2)各类型的CRISPR/Cas系统在表达和干扰阶段存在较大差异,在crRNA成熟过程中,Cas6同源蛋白加工Class1系统中的crRNA,而在Ⅱ型CRISPR系统中则由Cas9和RNase Ⅲ负责加工crRNA,V型和VI型CRISPR系统中分别由Cas12和Cas13加工crRNA;(3)在与靶DNA相结合过程中,Class1系统中crRNA与多个蛋白组成复合物与靶DNA相结合,而Class2 系统中crRNA与单个蛋白组成复合物发挥作用。
CRISPR/Cas系统的进化分类由Makarova等人在2011年第一次进行了整理,随后该分类于2015年和2020年分别进行了更新。在2020年最新的分类规则中,Class 1系统较2015年增加了4个亚型III-E、III-F、IV-B和IV-C,目前共16种亚型。与Class 1相比,Class 2系统只需要一个RNA引导的Cas核酸酶就能够完成对靶点的切割,使用简单、方便,有效的驱动了研究者在此类中寻找潜在的新基因组编辑和诊断工具。自2015年以来,该系统从2个类型和4个亚型,扩展到3个类型和17个亚型,这些新发现包括多种V型和VI型系统。
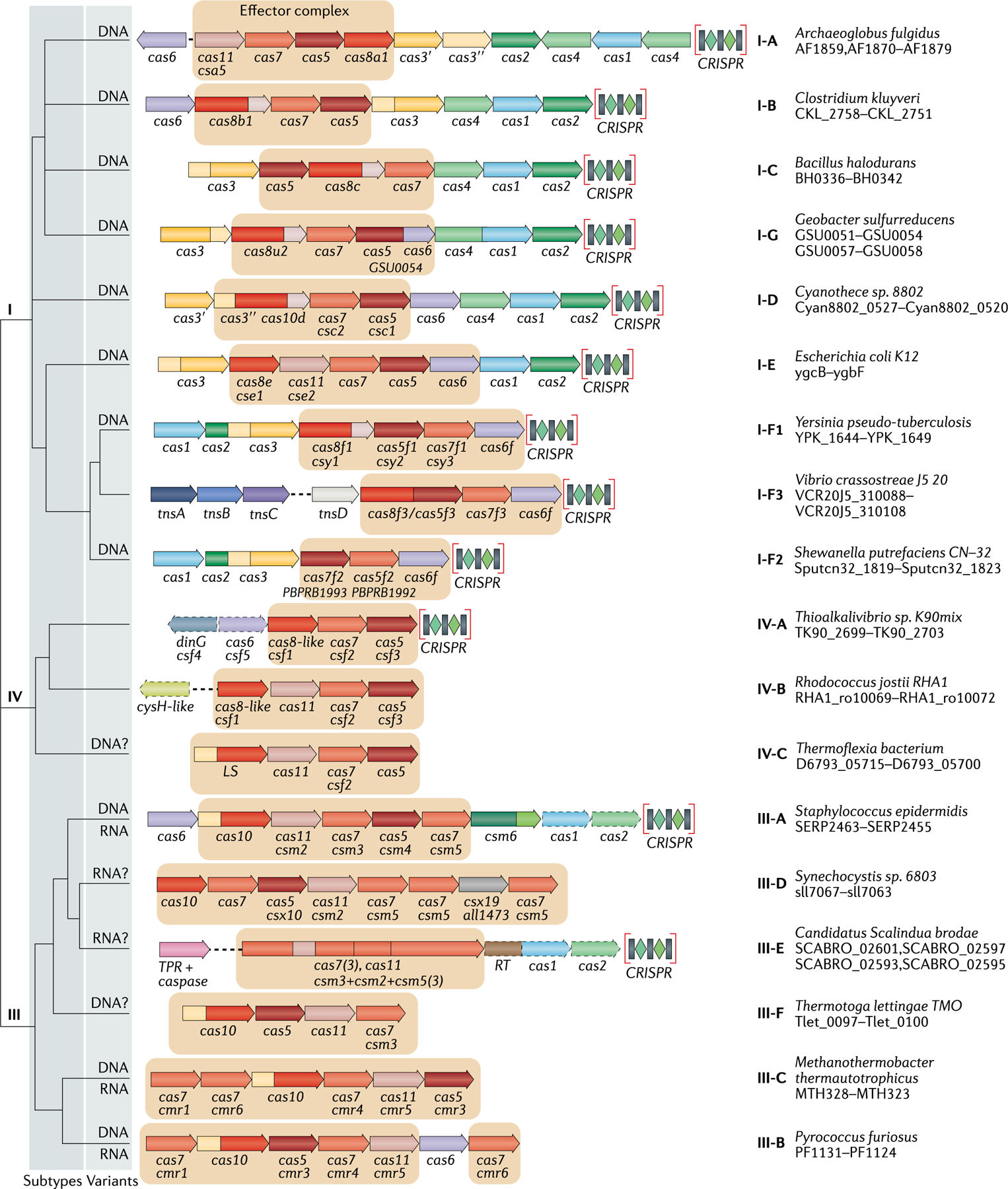
新的CRISPR/Cas 系统分类示意图-Class1
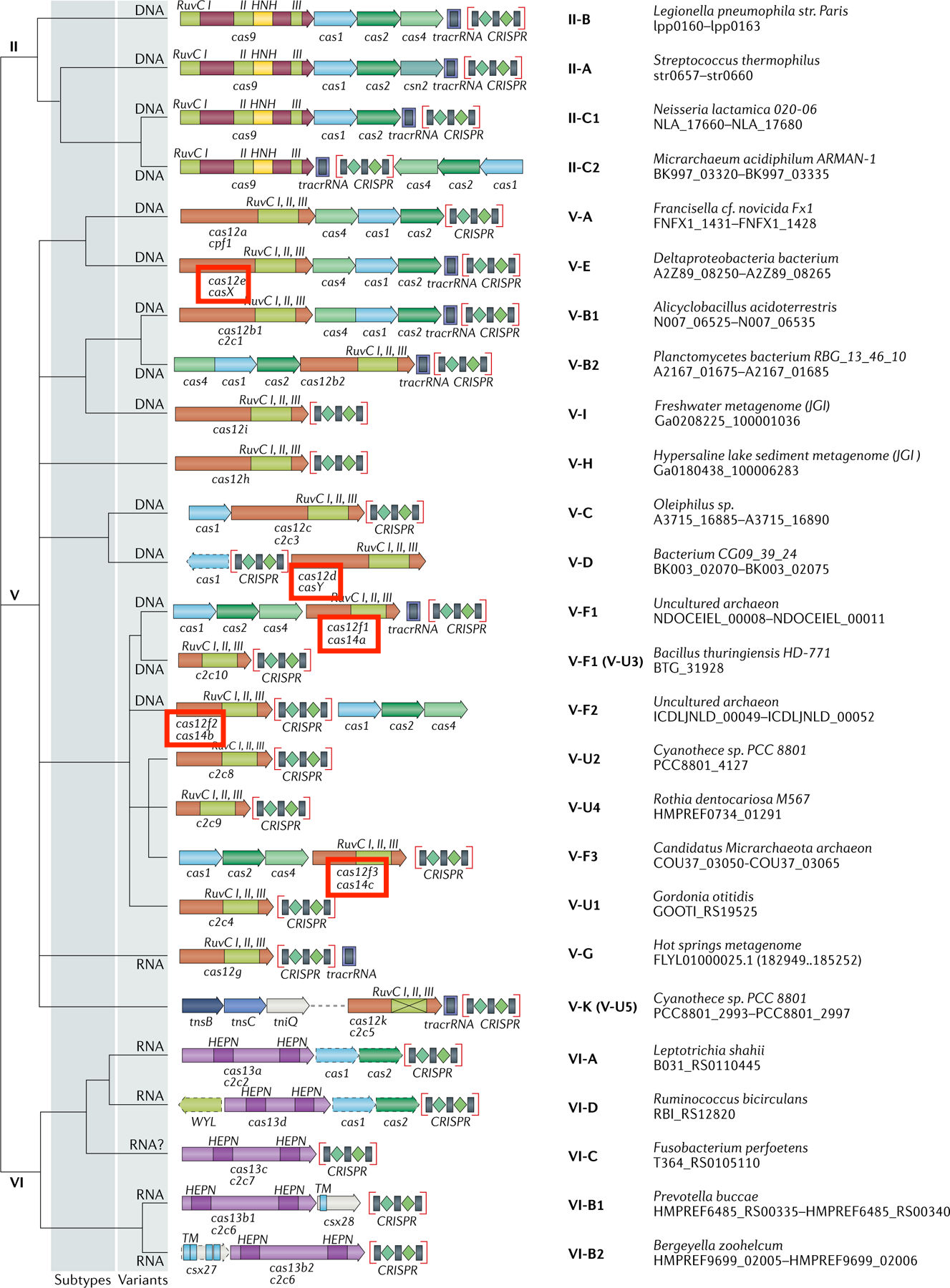
新的CRISPR/Cas 系统分类示意图-Class2
注:在Class 2系统中,某些编码基因下的Cas蛋白标注了两种不同的名称,如Cas12e(CasX),Cas12d(CasY),Cas12f1(Cas14a)等,这主要是由于不同的命名系统差异导致,可能与一些相关的专利或者命名权争议有关,这部分内容会在介绍完 CRISPR/Cas 系统的整体理论与相关应用之后陆续整理发出, 感兴趣的读者可以持续关注我们的网站和公众号,了解更多专业、有趣的学术新闻!
相信随着对CRISPR/Cas系统的进一步认识,基于该技术的基因编辑方法必将成为人类治疗疾病的一种常规手段,其治疗方式的个体化、最优化原则将为人类健康选择创造更多机遇,同时由于其高灵敏度和特异性,CRISPR/Cas诊断技术在病原体及耐药性基因检测、癌症突变分析和液体活检等不同领域的研究和应用将也会更加深入广泛。
参考文献:
1. Novel CRISPR–Cas Systems: An Updated Review of theCurrent Achievements, Applications, and Future Research Perspectives, 2021
2. Evolution and classification of the CRISPR-cas systems, 2011
3. An updated evolutionary classification of CRISPR–Cas systems, 2015
4. Evolutionary classification of CRISPR–Cas systems: a burst of class 2 and derived variants, 2020
5. A short overview of CRISPR-Cas technology and its application in viral disease control, 2021
6. Enzyme kinetics of CRISPR molecular diagnostics, 2021
7. Repurposing CRISPR-Cas12b for mammalian genome engineering, 2018
8. The chemistry of Cas9 and its CRISPR colleagues, 2017
9. 检测已知 CRISPR-Cas 系统及发掘未知 Cas 蛋白,2021
10. 新一代基因组编辑系统CRISPR/Cpf1,2017
11. 基于 CRISPR/Cas 系统的分子诊断技术原理 及应用研究进展,2021
12. CRISPR 核酸检测技术的研究进展,2021
13. Ⅰ-E型CRISPR/Cas系统介导适应性免疫分子机制研究进展,2016
14. 部分信息来源于网络
- 上一篇:无
- 下一篇:CRISPR介绍---CRISPR发展史